内容推荐
背景
在美国,许多关键药物供应不足,这种情况引起了患者强烈抗议,甚至还因此组织过国会听证会。位于急需药物清单榜首的是患者需要通过打针注射或者通过输液静脉注射的液体。事实上,美国联邦食品和药品监督管理局的短缺清单上将近 75% 的药物都是液体,如化疗药物、麻醉剂和营养液。
食品和药品监督管理局以及行业专家一致认为,问题主要源自生产过程中保护药物纯度所需遵循的严格且通常复杂的流程。仅仅在 2010 年这一年内,制药商生产的一半以上批次的注射药因细菌污染和工业颗粒杂质等质量问题而被丢弃。
一家制造商的故事说明了情况的严重性,以及公司如何利用自动化技术帮助克服这种情况。
挑战
对于这家位于美国的无菌注射药物生产商来说,每年包装线上的污染会导致两位数的批次损失。问题出现在使用吹瓶、灌装和封口一体化机器将药物从散装容器转移到单个塑料药瓶的过程中。
为了确保所有设备在灌装药物之前是无菌的,操作员通过打开并关闭整个过程中一系列阀门(20 到 30 个),手动给生产线加压。这会将空气和污染物排出。但是不按顺序打开阀门或者打开阀门时间不正确可能会造成产品批次质量下降。
人为失误并不是唯一的问题。有缺陷的阀门密封或仪表连接装置也可能引起压力损失,危及产品的纯度。生产线还缺乏针对潜在故障的报警系统,因此,工厂操作员在检测最终产品之前,不知道产品批次是否存在问题。
解决方案
为了寻找一个综合性的解决方案,制药商与 Automated Systems 公司 (ASI) 合作来升级其控制和可视化系统。ASI 开发了一个系统来自动控制生产线上的污染,在任何流程指标超过预设范围时发出预警,并跟踪和记录关键过程数据以核实每个已完成的批次是否是无菌的。
该解决方案所依靠的是一个基于 Rockwell Automation 硬件和软件的制造智能战略。ASI 工程师利用一种新型 Allen-Bradley® ControlLogix® 可编程自动化控制器设计了一种系统,该系统可以预先确定所有处理和排序步骤,包括关键的增压程序。
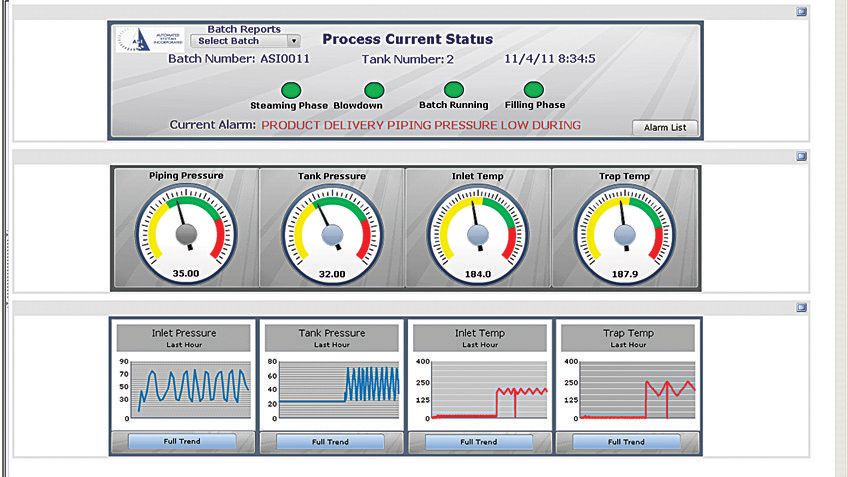
该系统集成了 Rockwell Automation 的 FactoryTalk 软件,其中包括运行 FactoryTalk® View Site Edition (SE) 软件的人机界面 (HMI)。HMI 在一个精致的模拟屏幕上显示系统的实时状态。操作员也可以通过安全的网络浏览器访问这个屏幕来实施远程监控,通过这个屏幕,操作员可以详细了解整个系统中每个阀门的状态以及压力和温度读数。
这使操作员能够在充分了解整个系统的情况下,快速且正确地执行合适的操作。FactoryTalk View SE 软件提示操作员执行某些操作并核实流程中各个步骤的变量。当出现警告或报警时,系统会自动发现潜在的故障位置,将产品隔离在该处,然后重新对生产线消毒。
为了改善记录保留和简化报告过程,ASI 将 FactoryTalk Historian 和 VantagePoint EMI 软件整合到了新的系统中。同时,应用程序跟踪和报告所有关键过程参数和报警。现在,操作员可以实时访问自动生成的界面、仪表板和报告中的关键生产数据,这样,他们可以防患于未然,及时发现任何潜在生产问题。业务经理可以评估历史数据,作出更明智的决策。
在各个运营周期结束时,新的系统会自动生成一个报告,其中将列出影响无菌状态的任何报警或情况。如果操作员发现异常,他们可以参考历史数据以查找发生错误的具体位置,并迅速针对这种情况采取补救措施。自动跟踪生产数据还能消除流程结束时对各个批次进行检测的需要。
报告以 PDF 格式进行存储,以便对批次进行追溯。工厂操作员和经理利用历史数据进行趋势和流程分析。
FactoryTalk Historian 和 VantagePoint EMI 软件还可满足监管报告要求。FactoryTalk Historian 相当于一个安全的记录储藏室,通过这个储藏室,制造商能够遵守 FDA 的电子记录规则。FactoryTalk VantagePoint EMI 使该系统可以将可靠的批次记录支持性数据相互关联,从而更好地遵守该机构当前的良好生产实践法规。
成果
自从实施了新的系统以后,制造商没有因污染而失去过任何批次的产品。每个成品批次价值都超过 250,000 美元,所以对新系统的投资很快就能收回来。
公司在遵守 FDA 报告法规方面花费的时间和金钱也较少,因为该系统会自动跟踪批次安全。
患者也从中受益,可以获得他们所需的更多药物。
发布时间 2015年5月28日